Jaké je množství hmoty a jak je určeno?
Promluvme si o tom, jaké množství látky,jak je termín používán v předmětech přírodovědného cyklu. Vzhledem k tomu, že kvantitativní vztahy v chemii a fyzice jsou věnovány vážnou pozornost, je důležité znát fyzický význam všech veličin, jejich měrných jednotek a rozsah použití.
Označení, definice, měrné jednotky
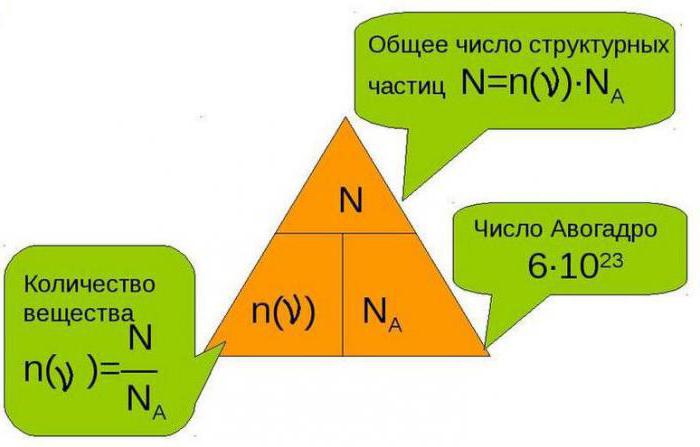
V chemii, kvantitativnívztah. Pro výpočet rovnic se používají speciální výpočty. Abychom pochopili, co je množství hmoty v chemii, dáme termín definice. Jedná se o fyzikální veličinu, která charakterizuje počet analogických strukturních jednotek (atomů, iontů, molekul, elektronů) přítomných ve hmotě. Abychom pochopili, jaké je množství hmoty, poznamenáváme, že toto množství má své vlastní označení. Při výpočtech, které vyžadují použití tohoto množství, použijte písmeno n. Jednotky měření jsou mol, kmol, mmol.
Hodnota hodnoty
Osmikrát, kteří dosud nevědí, jak psátchemické rovnice, nevím, jaké je množství hmoty, jak tuto hodnotu použít ve výpočtech. Po seznámení se s právem stálosti hmoty látek se význam tohoto množství stává jasným. Například při reakci spalování vodíku v kyslíku je poměr reakčních složek dva k jednomu. Je-li známá hmotnost vodíku vstupujícího do procesu, je možné určit množství kyslíku, které se účastnilo chemické reakce.
Použití vzorců pro množství látkyumožňuje snížit poměr mezi počátečními činidly a zjednodušit výpočet. Jaké je množství hmoty v chemii? Z hlediska matematických výpočtů jsou to stereochemické koeficienty stanovené v rovnici. Používají se k provedení určitých výpočtů. Způsob výpočtu počtu molekul je nepohodlný, je to Mole, které se používá. Při použití čísla Avogadra lze počítat s tím, že 1 mol kteréhokoliv reakčního činidla obsahuje 6,1023 molů-1.

Výpočty
Chcete chápat, jaké je množství hmoty? Ve fyzice se toto množství také používá. Je zapotřebí v molekulární fyzice, kde se provádí výpočet tlaku a objemu plynných látek podle rovnice Mendeleev-Clapeyron. K provedení jakýchkoli kvantitativních výpočtů se uplatňuje koncept molární hmotnosti.

Pod touto hmotností to znamenáodpovídá jednomu mólu určité chemické látky. Stanovte molární hmotnost relativními atomovými hmotami (jejich součet zohledňuje počet atomů v molekule) nebo zjistěte pomocí známého množství hmoty jeho množství (mol).
Žádná úloha kurzu školní chemie se nevztahujevýpočty rovnicí není úplná bez použití takového výrazu jako "množství látky". Vlastníte algoritmus, můžete se vyrovnat nejen s běžnými výpočty softwaru, ale také s komplexními úkoly olympiády. Kromě výpočtů hmotností hmoty je také možné pomocí této koncepce provádět výpočty v molárním objemu. To je důležité v případech, kdy se na interakci podílejí plynné látky.
</ p>


