Promluvme si o tom, jak určit typ hybridizace
Promluvme si o tom, jak určit typ hybridizace a také zvážit geometrickou strukturu molekuly.
Historie vzhledu
Na počátku dvacátého století, L. Pauling navrhl teorii geometrie molekul s kovalentní vazbou. Jako základ pro formování komunikace bylo provedeno překrývání elektronových mraků. Metoda byla nazývána valenčními vazbami. Jak určit typ hybridizace atomů ve sloučeninách? Autor teorie navrhl vzít v úvahu míchání hybridních orbitálů.
Definice
Abychom pochopili, jak určit typ hybridizace ve sloučeninách, přezkoumejte, co tento výraz znamená.
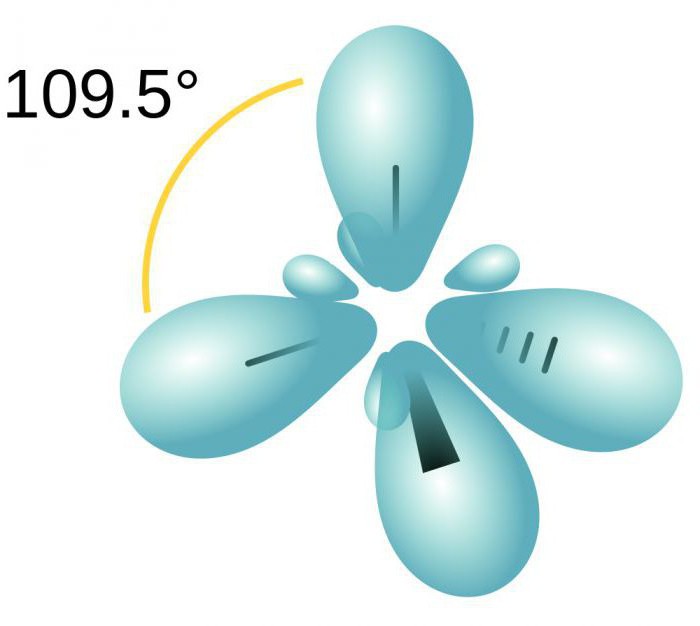
Hybridizace je směšováníelektronické orbitály. Tento proces je doprovázen distribucí energie v nich, změnou jejich formy. V závislosti na tom, kolik s- a p-orbitals jsou smíšené, typ hybridizace může být jiný. V organických sloučeninách může atom uhlíku existovat ve stavu sp, sp2, sp3. Existují také složitější formy, ve kterých se kromě sp, d-orbitals účastní.
Pravidla detekce anorganických látek v molekulách
Určete možnost hybridizace sloučenins kovalentní chemickou vazbou, mající typ ABn. A je základní atom, B je ligand a n je číslo od dvou nebo více. V takovém případě se k hybridizaci připojí pouze orbitální valence hlavního atomu.
Metody stanovení
Pojďme se bavit podrobněji o tom, jak určit typhybridizace. V chemickém smyslu tento pojem znamená změnu v energii a tvaru orbitálů. Podobný proces je zaznamenán v těch případech, kdy se elektrony používají k vytvoření vazby, které patří k různým typům.

Chcete-li pochopit, jak určit typ hybridizace,zvážit molekulu methanu. Tato látka je prvním zástupcem homologní řady nasycených (omezujících) uhlovodíků. Ve vesmíru molekula CH4 je čtverec. Jediný atom uhlíku vytváří vazby s vodíkem, podobný energii a délce. Pro vytvoření takových hybridních mraků se používají tři p- a jeden es-elektron.
Čtyři mraky jsou smíšené a tam jsou čtyřiidentických (hybridních) druhů, které mají tvar nepravidelného čísla osm. Tento typ hybridizace se nazývá sp3. Všechny uhlovodíky, které obsahují pouze jednoduché vazby, jsou charakterizovány tímto typem hybridizace atomu uhlíku. Úhel valentine je 109 stupňů 28 minut.
Pokračujeme v rozhovoru o tom, jak určit typhybridizace. Příklady nenasycených uhlovodíků z řady ethylenu poskytují představu sp2-hybridizace. Například v molekule ethylenu čtyř valenčních elektronů při tvorbě chemické vazby se používají pouze tři. Zbývající nehybridní p-elektron vede k vytvoření dvojné vazby.
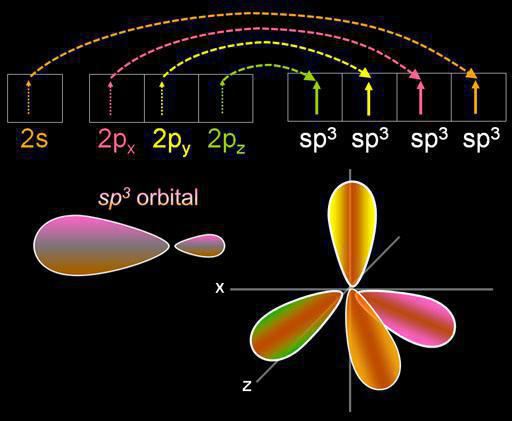
Acetylen je nejjednodušší zástupcetřídy CnH2n-2. Charakteristickou vlastností této skupiny uhlovodíků je přítomnost trojité vazby. Ze čtyř valenčních elektronů atomu uhlíku pouze dva mění svou podobu a energii a stávají se hybridními. Dva zbývající elektrony se podílejí na tvorbě dvou dvojných vazeb, které určují nenasycenou povahu této třídy organických sloučenin.
Závěr
Vzhledem k otázce kovalentníchemické vazby pro organické a anorganické látky, berou v úvahu hybridizaci atomových orbitálů. To přizpůsobuje jejich energii a tvar. Elektron umístěný v blízkosti jádra vázaného atomu je charakterizován sadou orbitálů, které mají stejné kvantové číslo. Informace o typu hybridizace umožňují vyhodnotit chemické vlastnosti látky.
</ p>




