Úrovně strukturní organizace proteinové molekuly nebo struktury proteinu
Struktura proteinové molekuly je studována ve více než 200roky. Je známo mnoho proteinů. Některé z nich jsou syntetizovány (například inzulín, RNáza). Základní strukturní a funkční jednotky molekul proteinů z aminokyselin. Dále karboxylové a aminové skupiny a proteiny obsahovat další funkční skupiny, které určují jejich vlastnosti. Takové skupiny zahrnují umístěn v boční molekule větvení proteinu: karboxylovou skupinu kyseliny asparagové nebo kyseliny glutamové, aminoskupinou lysinu nebo hydroxylysin, guanidinové skupiny argininu, imidazolová skupina histidinu, hydroxylovou skupinu serinu a threoninu, fenol skupina tyrosinu, sulfhydrylové skupině cysteinu, disulfidová skupina cystinu, thioether skupina methioninu, fenylalaninu benzelnoe jádro, alifatické řetězce jiné aminokyseliny.
Existují čtyři úrovně strukturální organizaci proteinových molekul.
Primární struktura proteinu. Aminokyseliny v proteinové molekule jsou spojeny peptidovými vazbami a tvoří primární strukturu. Závisí to na kvalitativním složení aminokyselin, jejich počtu a pořadí spojení mezi sebou. Primární struktura proteinu nejčastěji určuje Senger. Testovaný protein je ošetřen roztokem ditrofluorbenzenu (DNP), což vede k tvorbě dinitrofenyl-proteinu (DNP-protein). Později se DNP-protein hydrolyzuje, zbytek molekuly proteinu a aminokyseliny DNP se tvoří. DNP-aminokyselina je z této směsi izolována a je hydrolyzována. Produkty hydrolýzy jsou aminokyselina a dinitrobenzen. Zbytek molekuly proteinu reaguje s novými částmi DNP, až se celá molekula rozpadne na aminokyseliny. Na základě kvantitativního studia aminokyselin se vytvoří schéma primární struktury jednotlivých proteinů. Primární struktura proteinů je inzulin, myoglobin, hemoglobin, glukagon a mnoho dalších).
Způsobem, popsaným v Edman proteinu se zpracuje s fenylisothiokyanátem. Někdy pomocí proteolytických enzymů - trypsin, pepsin, chymotrypsin, peptidázy, atd
Sekundární struktura proteinu. Američtí vědci, pomocí rentgenové analýzy, zjištěno, že polypeptidové řetězce proteinu často existují ve formě alfa-šroubovic a někdy beta struktur.
Alfa-spirály jsou porovnávány s točitým schodištěm,kde je funkce stupňů provedena aminokyselinovými zbytky. V molekulách vláknitých proteinů (hedvábný fibroin) jsou polypeptidové řetězce téměř úplně roztaženy (struktura beta) a umístěny ve formě kuliček stabilizovaných vodíkovými vazbami.
Alfa šroubovice může spontánně tvořitsyntetické polypeptidy (dederon, nylon), které mají molekulovou hmotnost 10 až 20 000 Da. Na určitých místech molekuly proteinu (inzulínu, hemoglobinu, RNAázu) je alfa-helikální konfigurace peptidového řetězce narušena a vytvářejí se spirální struktury jiného typu.
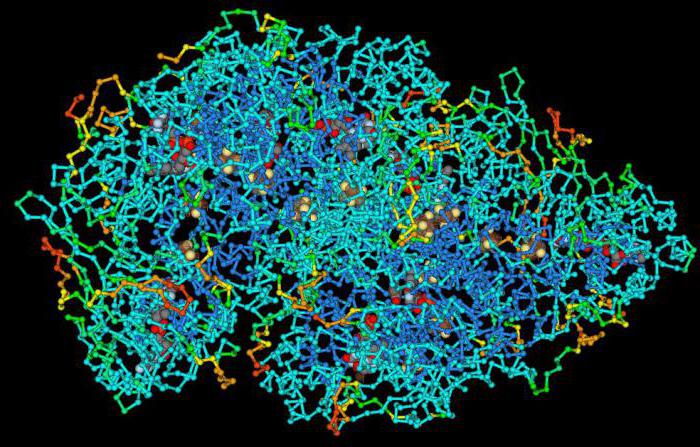
Terciární struktura proteinu. Spirální úseky polypeptidového řetězce molekuly proteinu jsou v různých vztazích, které předurčují terciární (trojrozměrnou) strukturu, objem a tvar molekuly proteinu. Předpokládá se, že terciární struktura vzniká automaticky v důsledku interakce aminokyselinových radikálů s molekulami rozpouštědla. V tomto případě jsou hydrofobní radikály "vtaženy" do molekuly proteinu, tvořící jejich suché zóny a hydrofilní skupiny jsou orientovány směrem k rozpouštědlu, což způsobuje tvorbu energeticky příznivého potvrzení molekuly. Tento proces je doprovázen tvorbou intramolekulárních vazeb. Terciární struktura molekuly proteinu je dešifrována pro RNAse, hemoglobin, kuřecí vejce lysozymu.
Kvarterní struktura proteinu. Tento druh struktury proteinové molekuly vzniká v důsledku spojení několika podjednotek do jediné komplexní molekuly. Každá podjednotka má primární, sekundární a terciární strukturu.
</ p>